出品:科普中国
制作:中国科学院生物医学工程技术研究所
监制:中国科学院计算机网络信息中心
引言:2014年的诺贝尔化学奖颁给了三位科学家:Eric Betzig、Stefan W。 Hell和William E。 Moerner,以表彰他们在超分辨荧光显微镜领域做出的贡献。超分辨荧光显微技术在生命科学领域具有重要意义,但超分辨有什么优点,起到什么作用,怎样实现超分辨?这些问题,让我们来为大家一一解答。
 图1 2014年诺贝尔化学奖得主 图片来源:http://www.nobelprize.org/
图1 2014年诺贝尔化学奖得主 图片来源:http://www.nobelprize.org/一沙一世界,一花一菩提——生命科学都做些什么
每个生物个体都是一个复杂的系统,以身高170厘米的小明为例,他的手部表面覆盖着皮肤(组织),皮肤由细胞组成,细胞内含有细胞核(细胞器),细胞核的核仁里含有遗传物质DNA(分子),分子是化学过程和生命过程的最小单元。生命科学从微观层面观察生命过程,大到组织和细胞,小到蛋白质、DNA、RNA等化学物质,通过研究它们在生命过程中的变化,揭示生命的物质基础和基本现象。从尺度上来说,组成小明身体的细胞平均尺寸大约几十微米,而最大的分子——蛋白质的尺寸只有几十纳米,相当于他身高的1/107。
孔子告诉我们,工欲善其事,必先利其器。细胞和分子这么小,想要看到它们,需要显微成像技术的帮助。
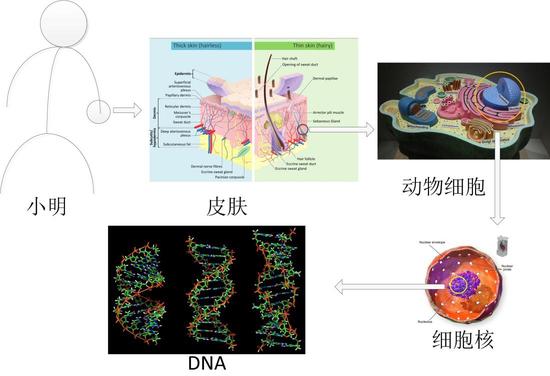 图2 将人放大数百万倍,“看到”另一个精彩的世界 图片来源:维基百科
图2 将人放大数百万倍,“看到”另一个精彩的世界 图片来源:维基百科盲人摸象与隔岸观火——原子力探针显微与光学探针显微
顾名思义,显微成像是一种观察微小物体的手段。原子力探针和光学探针是两种常用的显微技术,前者就像盲人摸象,利用一个微小的探针接近样品,通过反馈的作用力来实现观测,这种触摸的方式只能探测样品表面,还会对脆弱的样品造成损伤,不适用于观察生命过程;相比之下,光学探针显微就像隔岸观火,把探测用的光束打到物体上,通过收集透射或者反射光的方式来进行观测,对样品的影响很小。
 图3 两种常见的显微镜 图片来源:维基百科
图3 两种常见的显微镜 图片来源:维基百科为了提高光学显微的成像效果,以便从复杂的细胞组织中提取出自己想要的细节,科学家还采用了荧光标记的方法,在细胞中加入特殊的荧光标记物,这些标记物在特定的光照下,有的发出红光,有的发出绿光,而且每种荧光标记物都具有一定的选择性,只与细胞中既有的特定分子结合,然后发出荧光。荧光成像大大提高了光学显微成像的对比度,还帮助科学家分辨细胞中的不同结构。图中所示是牛肺动脉内皮细胞,细胞核呈现蓝色,线粒体呈现红色,微丝呈现绿色。然而光学显微也有自己的缺陷——就像用望远镜看天上的星星,即使再先进的、口径再大的望远镜,也没法看清所有星星;显微成像的分辨能力也受到光学成像系统的限制,这种限制来自于光的衍射,因此被称作衍射极限。
 图4 牛肺动脉内皮细胞 图片来源:维基百科
图4 牛肺动脉内皮细胞 图片来源:维基百科墓碑上的公式——衍射极限
波动性是光的基本特性之一,由此产生的衍射效应始终困扰着包括显微、望远在内的光学成像系统。德国物理学家Ernst Abbe发现了显微镜的衍射极限,并将公式刻在自己的墓碑上。这里我们不去详细分析衍射极限的成因,只需要大家知道这样一个结论:由于衍射极限的存在,显微成像系统的照明光只能在样品上形成有限小的圆形光斑,被称作艾里斑;同样地,样品上的分子只能在成像相机上形成有限小的圆斑。从成像的角度来说,衍射极限影响下的显微成像系统只能分辨有限小的细节,一般在200纳米到300纳米之间。
前面已经说过,细胞的直径大约几十微米,想要研究细胞内的生命过程,至少要能看清细胞器才行。传统光学显微镜的分辨率用来看细胞还马马虎虎,对细胞器就只能看个大概,没法满足生命科学研究的需求。近年来,科学家们从不同的角度入手,实现突破衍射极限的光学显微成像,也就是文章开头提到的超分辨荧光显微镜。超分辨的实现途径很多,有结构光照明(SIM)、受激发射损耗(STED)、光激活定位显微(PALM)、随机光学重构(STORM)等,限于篇幅我们只讲获得诺贝尔奖的两种——Stefan W。 Hell的受激发射损耗(STED)和Eric Betzig、William E。 Moerner的光激活定位显微技术(PALM)。
 图5 衍射极限限制了显微镜的分辨能力 图片来源:维基百科、果壳网
图5 衍射极限限制了显微镜的分辨能力 图片来源:维基百科、果壳网管中亦可窥豹——受激发射损耗显微镜
传统光学显微镜采用宽场成像的方式,照明光一次照亮整个成像范围,然后用相机对整个成像范围进行曝光成像,一次获得整幅图像。“管中窥豹”型的扫描成像则有所不同,照明光聚焦在样品上,形成一个极小的光点——也就是所谓的“管”,每次只对光点对应的区域进行成像;当我们改变光点的位置,使它依次扫遍整个样品,也就获得了一幅完整的图像。有人要问了,即使采用“管中窥豹”的方式,每次聚焦的光点依然受到衍射极限限制,系统分辨能力比起所谓的宽场成像没有提高,扫描过程又增加了系统的复杂度,不是自找麻烦吗?Stefan W。 Hell的回答很简单:只要设法缩小“管中窥豹”的“管”,就能提高系统的分辨能力,实现超分辨。
通常的荧光成像是这样的:荧光分子在吸收了照明光(或者叫激发光)A之后,会在很短的时间持续发出荧光B。扫描成像系统的分辨能力取决于A在样品处的聚焦光点大小。Hell找到了荧光的开关——第三种光C,在C的照射下,荧光分子即使吸收了激发光A,也没法再发出荧光B。Hell让开关C同样打在样品上,形成一个四周亮、中心暗的“面包圈”,“面包圈”中心的暗区域比艾里斑还要小;然后把面包圈套在艾里斑上,就像在“管”的出口又加了一个小孔,使“管”的直径大大减少,也就提高了整台显微镜的分辨能力。

图6 “面包圈”限制了激发光A的有效范围
“我只看到星星”,“我看到了银河”——光激活定位显微
荧光分子是荧光样品的最小发光单元,由于衍射极限的限制,在相邻的两个荧光分子同时点亮时,我们只能看到一个光斑,但如果每次只点亮一个分子,就可以通过光斑,计算得到荧光分子的准确位置。
Eric Betzig和William E。 Moerner采用的就是这样一种方法,如果说STED技术核心是“擦除”,那么PALM技术的核心就是“定位”:Moerner发现存在光D可以“打开”荧光。通过控制D的照射剂量,保证每次只有少量荧光分子处在打开状态;当荧光分子在开与关之间切换时,整幅图像中的荧光信号就会像银河中的星星一样亮暗闪烁,只要进行足够多次的开关和成像,就可以组合出整个样品的图像。
 图7 溶酶体膜在不同显微镜下的成像结果。(左)传统光学显微镜成像; (中)光激活定位显微镜成像;(右)放大的光激活定位显微镜成像。 图片来源: 果壳网
图7 溶酶体膜在不同显微镜下的成像结果。(左)传统光学显微镜成像; (中)光激活定位显微镜成像;(右)放大的光激活定位显微镜成像。 图片来源: 果壳网集百家之长,成一家之言——交叉学科的胜利?
作为光学发展史上的重大进步,衍射极限的突破显然是一个物理学问题,三位科学家以化学方法为工具,突破衍射极限并摘走了2014年诺贝尔化学奖,由此受益最大的则是生物学。更有趣的是,三位诺贝尔奖得主都是物理学出身,因此超分辨显微成像技术可以称得上是交叉学科的重大胜利。
随着超分辨技术的发展与成熟,国际上主流研究方向已经由系统本身转向应用,几大显微公司也纷纷推出各自的商业化产品,但空间与时间、成本与性能的博弈还在持续,在可以预见的将来,超分辨显微成像技术仍有进步的余地。

“科普中国”是中国科协携同社会各方利用信息化手段开展科学传播的科学权威品牌。
本文由科普中国移动端出品,转载请注明出处。

