来源:放大灯
作者:张旌
20世纪50年代,时任广州中山医学院儿科教授兼主任的钟世藩,开始了乙脑病毒的培养和分离工作。因为缺乏研究经费,他自费买来小白鼠,在自家书房研究,顺便还把自己儿子培养成了一名“小白鼠饲养员”。
钟世藩所使用的小白鼠,对中国人来说并不陌生——如今,人们经常以此来形容“试验品”。
事实上,在中国实验室中常见的小白鼠,是1946年才借道印度到云南昆明,进而在国内广泛使用的品种。
在这个一开篇就格外”难过“的鼠年,我们来聊聊人类科研事业里不可替代的小鼠。

“小白鼠”,BALB/c 实验小鼠 | Wikipedia
来自小鼠的“救命药”?
在科学实验中,小鼠是其中应用最广的一类被试对象,它也出现在最近的新闻中。
2020年1月21日,一家名为京天成的生物公司官方微信公众号发布了这样一篇文章:

图丨京天成生物官方公众号
这个重磅的消息似乎给当下灾情带来了曙光。但随后在财经网的进一步报道中,京天成生物回应称:目前只是用小鼠实验得到的抗体,远不能应用于临床。尽管该公司表示,以这样的形式放出消息是为了和医药圈的人进行探讨,为未来做储备,但难免有蹭热点之嫌。
撇开其它炒作因素,利用实验小鼠制备抗体确实是常见手段。
人具备免疫系统,且能够在体液免疫的帮助下,对入侵人体的有害因素——抗原,产生特异性的抗体。这之后,如果同样的抗原再次入侵,抗体就能够识别这些抗原,引导免疫系统消灭这些抗原。
但我们不能用人体作为生产抗体的容器,所以实验小鼠便派上了用场。抗体药物开发者们利用小鼠的免疫系统,制备能够识别目标蛋白(病原体)的抗体,作为药物来治疗一些人类疾病。
如果把入侵人体的病毒、细菌等抗原看作是一把一把的锁,那人体的体液免疫系统就是一个锁匠,能够针对不同的锁配出对应的钥匙——抗体。一旦拥有了这些钥匙,下次再碰到这些锁侵入人的身体,便能够打开这些锁,叫来锁匠的朋友们(免疫系统的其它部分)消灭这把锁。
这只是小鼠成为人类“替身”的一个典型案例。现代医学实验的每个环节,都离不开各种类型的小鼠:从认识疾病,解释其背后的机制,再到新药的研发和检测,小鼠都功不可没。
小鼠们可谓“当代银针”。
天生适合做实验?
小鼠易于繁殖,每一代数量多,寿命有限,遗传信息清晰……所有这一切特点 ,都昭示着它们仿佛是“天生用来做实验的命”。
但事实是,这些大量用于生化实验的小动物,并非“老鼠过街”的那些老鼠,而是人类有意培育的品种,其皮毛颜色也不仅仅是白色。
实验室里的小鼠起源自人人喊打的——家鼠。
1907年,哈佛大学本科生克拉伦斯·库克·利特尔(Clarence Cook Little)在其导师指导下,开始研究小鼠皮毛颜色的遗传规律,即“什么颜色的小鼠能生出什么颜色的小小鼠”的问题。
克拉伦斯用了两年时间培养,得到一对浅棕色皮毛的家鼠(浅棕色皮毛由隐性基因决定,这意味着这对小鼠是“纯种”,其后代只会是浅棕色)。之后的几年,他用这对小鼠的后代,有“兄弟姐妹”关系的小鼠近亲繁殖,筛选强健的小鼠继续繁殖,如此重复。
由于近亲繁殖,每一代小鼠的父母的基因组差异越来越小,小小鼠的基因也越来越统一。在繁育超过二十代小鼠之后,第一个纯系(近交品系)小鼠诞生了,还有一个奇怪的名字:dbr(后被更名为DBA)[1]。
近交品系小鼠的特点是:它们的基因组序列完全一致。
所以使用这类小鼠做实验,会比较省心:不同的小鼠个体不易引发较大实验数据的偏差,能有效减少实验数量和变量波动,大幅提高实验的可重复性。
其他科学家也开始培养新小鼠。后来几年里,两个新品系小鼠先后诞生:一类是白色的纯系小鼠(BALB/c,1913年),用于行为学实验[2](这个可能就是我们常常提及的“小白鼠”的鼻祖了);另一类是基于前述两种小鼠的新品系(1920年)[3]。
进入20世纪20年代,克拉伦斯在著名的冷泉港实验室又创造出黑色和棕色,两个新的实验小鼠品系[1],其中黑色系小鼠(C57BL),可能是全球范围内最重要的纯系小鼠之一。

一只雌性的 C57BL/6 实验用小鼠。图丨 Wikipedia
最先做起小鼠生意的人,正是第一个纯系小鼠的创造者——克拉伦斯。
卖小鼠卖出诺奖
1929年,克拉伦斯用募捐得来的5万美元,在缅因州的巴尔港创立了杰克森实验室(The Jackson Laboratory),当时实验室只有8名员工。
1933年,杰克森实验室开始正式对外出售实验用纯系小鼠,成为世界上第一家卖实验小鼠的机构。

克拉伦斯·库克·利特 | 杰克森实验室官网
得益于“卖小鼠”的生意,在此后的90年中,杰克森实验室的规模从9人,发展到现在的70多个团队,超过2200位员工,分布在美国三个州以及中国上海的四个研究所。
随着科学研究和疾病模型需求日益翻新,杰克森实验室小鼠的品系数量也不断增多,目前已超过11000种。
近期小鼠“mighty mice”还飞上太空帮助科学家更好的研究疾病 | SpaceX
其实杰克森实验室的成立初衷并非赚钱,而是希望以小鼠为研究对象,帮人类理解癌症,并验证克拉伦斯提出的“癌症可遗传”的设想。如今,随着现代医学的发展,实验室的愿景也而不断拓宽。现在他们专注于人类及其它哺乳动物基因组的复杂特性,希望能够揭开关于人类疾病的秘密。
别以为杰克森实验室只是个“卖小鼠”的商人角色,在奠定现代医学奠定基础的过程中,这家实验室可是与有荣焉。科技史上一系列研究突破——包括26个诺贝尔奖在内——都与杰克森实验室有关。
其中,1980年诺贝尔生理学或医学奖获奖者乔治·斯内尔教授(George Snell),就来自杰克森实验室。他对人体免疫系统组织相容性的探索,让器官移植成为可能。

1980年诺贝尔奖得主-乔治·斯内尔教授 | 杰克森实验室官网
另外还有3位诺奖获得者,曾是杰克森实验室夏令营的毕业生;其余22项诺贝尔奖得主的研究中,也都使用了杰克森实验室提供的实验小鼠。这些工作包括了一些鼎鼎大名的研究,如哺乳动物的第一次骨髓移植、干细胞治疗和体外受精等。
而作为一家独立的非盈利性生物医药研究机构,杰克森实验室除了从科研模型和相关服务获益(2018年营收2.85亿美元),每年还有1/4的收入来自官方资助[4]。
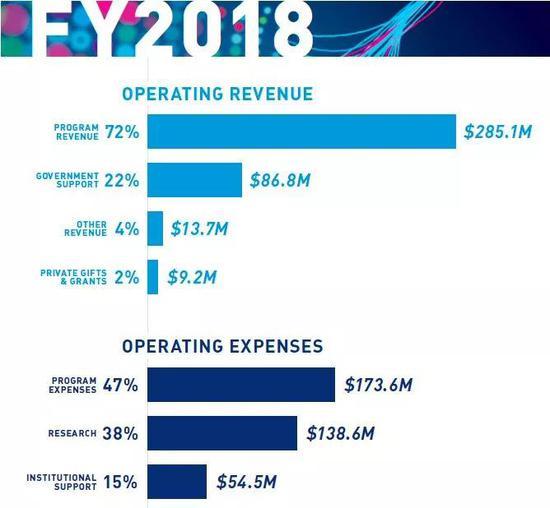
2018年杰克森实验室收入和支出 | 杰克森实验室官网
全球科学研究与医疗领域的市场规模庞大,卖小鼠的也不止杰克森实验室一家,还有人把小鼠生意做成了上市公司——查尔斯河实验室(Charles River Laboratories)。

亨利·福斯特 | 查尔斯河官网
70多年前,一位年轻的兽医亨利·福斯特(Henry Foster)就开始向本地研究人员出售实验动物,他曾一人包揽了杂交、喂养、照顾和配送的工作。如今,查尔斯河实验室市值约74亿美元,2018年营收约22.7亿美元,在全球20个国家的80个站点,有超过14700名员工,俨然一头商业巨兽[5]。
查尔斯河实验室2018年的财报显示,超过一半的业务收入来自药物研发与安全评估(你可以简单地理解为帮药企做动物实验,验证药品安全性),而传统的实验模型(比如卖小鼠、兔子等)和研究服务仅占1/5左右[5]。
查尔斯河实验室主要有3个不同的业务板块。2018年,其商业客户包括了各大药厂、生物科技公司、医疗器械公司、诊断行业、农业、化工行业、医院、科研机构以及行政部门等。
凭着悠久和广泛的业务,查尔斯河实验室在生物医药产业的地位举足轻重。其服务几乎成为了行业内公司必需的“基础设施”,渗透率高、营收来源分散,而不是倚赖个别大客户的采购——其财报显示,没有任何一家单一客户占据其总营收的2.5%以上,分业务板块看,也没有客户贡献各板块超过6%营收[5]。
以2018年为例,当年获美国食品药品监督管理局(FDA)批上市的新药中,在研发或生产过程中都有查尔斯河实验室的参与和支持的多达85%。

查尔斯河实验室2018年概览 | 查尔斯河实验室官网
小鼠的重要性不限于生物医药产业,在心理和社会等学科实验也要用到小鼠。对小鼠的多样化需求,也给这些卖小鼠的公司带来了更多挑战,不过,生物技术的不断进步,尤其基因编辑手段出现后,创造特定疾病或基因缺陷的动物模型也越来越容易。
旺盛和多样化的需求,也吸引更多公司想要分一杯羹。
谁动了谁的小鼠
杰克森实验室与查尔斯河实验室的成就固然令人敬佩,但并未占尽天下生意。
它们的业务壁垒最大敌人可能是——时间。
随着时间推移,各地小鼠使用与培养机构越来越多。它们与两大实验室也有业务往来,合作和竞争能够促进产业的发展,但利益面前,纠纷在所难免。
2017年9月,南京大学及其两家附属科研单位——南京生物医药研究院和南京大学模式动物研究所,就遭遇了杰克森实验室起诉。后者认为,南京大学方面从杰克森实验室购入小鼠后,违反了原本的销售协议,私自养殖并低价销售其后代[6]。
杰克森实验室发起的起诉意味深长,因为南京生物医药研究院规模太大了,它是亚洲最大的遗传基因工程小鼠研发中心,拥有的实验动物品系总量达3000多种,位居世界第四。以这种体量来抢市场,杰克森实验室无论如何不能忍。

纠纷的主角——NOD小鼠 | 杰克森实验室官网
杰克森实验室当初卖给南京大学方面的小鼠,是名为 NOD/ShiLtJ 的小鼠品系(其中LtJ是杰克森实验室的缩写),南京大学方面使用的小鼠,名字为NOD/ShiLtJNju,多了个Nju(即南京大学英文缩写)。
南京大学真的见小鼠而忘义了吗?
事情没有那么简单。杰克森实验室和南京大学两家小鼠系出同源,他们都在自有小鼠亚系的基础上改造出用于疾病模型的小鼠品系,并对外出售,追溯起来,关系如下——
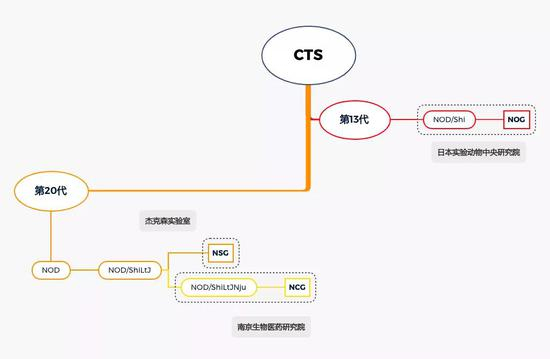
NOD小鼠品系演化过程 | 放大灯团队整理
目前,杰克森实验室和南京大学的诉讼还没结果,杰克森实验室只能任由南京大学的小鼠一步步侵蚀和瓜分市场份额。但追究起来,杰克森实验室自己也遇到过类似情况。
杰克森实验室的小鼠(NOD/ShiLtJ)不是从石头里蹦出来的,而与日本实验动物中央研究院有着说不清道不明的关系。2009年,杰克森实验室因为售卖疾病模型小鼠(NSG),曾被日本实验动物中央研究院起诉,但日方被判败诉。法庭给出的理由是:杰克森实验室的基础品系小鼠,在美国已繁衍了20代以上,已不再是来自日本的那一种。
所以,在南京大学的这场官司中,到底谁遭遇了不公,还不好说。我们唯一能确定的是,这两场“基因改造动物专利”纠纷背后,是全世界相关制度的缺失,而随着技术发展和商业利益的驱动,类似纷争将越来越多。
两场官司中的争议焦点:NOD小鼠,为何如此抢手?
NOD(Non-obese diabetic),中文译作“非肥胖糖尿病”,这种小鼠患有先天性非肥胖糖尿病和多种免疫异常病;另一种小鼠品系叫SCID(Severe combined immunodeficient),即重症联合免疫缺陷小鼠,这种小鼠缺乏基本的免疫功能。
上述的两种小鼠相交培育出的基础品系,是这几家公司产品的共同来源。
在构建小鼠疾病模型时,研究人员不希望小鼠出现免疫排斥反应,让其能更好地模拟人类肿瘤等疾病。这样,缺乏免疫功能的小鼠就诞生了。
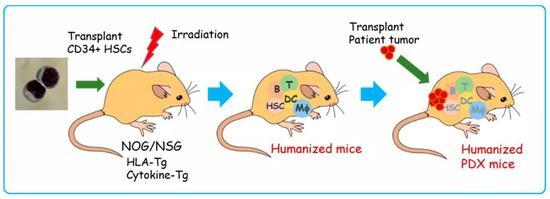
利用NOG/NSG小鼠构建人类肿瘤模型 | Cell
但研究人员已经停不下来了。他们利用化学诱导、基因编辑或是直接移植的方法,让这些携带免疫缺陷的小鼠成为合适的疾病研究模型,以便用来开发新药或测试其它医疗手段。
这种小鼠的意义非凡。几乎所有的药物研发成功后,都需要经过动物试验来确保其安全性和有效性,才能申请开展临床试验,进而上市。此前的很多单克隆抗体或者药物也都来自小鼠,例如大名鼎鼎的抗癌神药——K药(帕博利珠单抗)就有部分结构来自小鼠的免疫系统产物。
谁来善待小鼠?
2019年夏天,在一天早晚例行的检查中,实验室管理员发现笼子里有一只死去的小鼠。
没人知道它为什么死掉。博士后Joe的实验计划显示,小鼠的死亡时间提前了好几天,而且,其体征记录还少了几次。按学院规定,这只小鼠被判定为虐待致死。
“虐待小鼠”的报告导致 Joe 受到严重警告,实验室的其他人也遭池鱼之殃:在此后的三个多月,整个实验室被禁止开展任何动物相关的实验。
这起发生于国外某知名高校的事件,折射出国外对于实验动物福利的管理之严。但在国内,每天都有小鼠不明不白地死去,乏人问津。
在不少人看来,这似乎不是什么大事儿——与科学实验结果相比,为之牺牲的小鼠不值一提。
但是用小鼠做实验的行为遭到动物保护主义者的质疑。尤其针对“定制小鼠”,他们认为,既然那些以基因编辑改造胚胎的行为会遭抨击,那么,为了特定目的而“定制小鼠”(或其它动物),使它们天生罹患各类肿瘤、缺陷或其它疾病,并将这些 “病重”的小鼠摆上台面,明码标价,这种行为同样不妥——小鼠也是生命,也应该得到善待。
一些国家和机构也确实做出了相应的回应。
英国1986年的发布了《动物(科学程序)法》,用以规范实验动物的使用。其中指出,保护动物是指“所有活着的非人类的脊椎动物以及所有头足类动物” [7],足见英国对实验动物保护的态度有多强硬。如今,英国已禁止利用实验动物来检验烟草类、化妆品以及日用产品等[8]。
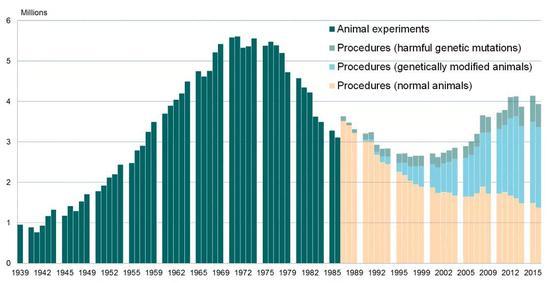
1939 - 2018年英国地区实验动物使用情况 | Understanding Animal Research
英国对实验动物的保护力度一直在加强,自2014年起,英国还将实验动物分为五个等级[7]:
美国对此问题也一直十分关注,从1985年起就出台了一系列有关实验动物的管理和使用的政策。在美国相关部门2019年9月的一份文件中就提出 [9], 对动物会造成痛苦或不良应激反应的实验,应当慎重考虑是否有替代方案,如体外试验或计算机模拟。

国内外实验动物相关政策法规 | 中国实验动物信息网
目前在国内,关于实验动物管理相关的文件多是行政法规,如2017年3月修订的《实验动物管理条例》,其中仅有一条十分宽泛的规定,在实验过程中需要爱护实验动物[10]:
第二十七条 从事实验动物工作的人员对实验动物必须爱护,不得戏弄或虐待。
很多国内其它的政策主要集中于进出境实验动物的管理以及检疫监管工作,而对于如何对待实验动物,则无明确规定。
然而很多动物保护人士并不买账。因为全球范围内实验用小鼠的数量,并没有因为法律保护而明显降低(我们甚至不知道,每年全世界到底“用”掉了多少只实验小鼠),且基因编辑小鼠和疾病模型小鼠的日益增多,让这些小鼠遭受的痛苦雪上加霜。
但科学进步、社会发展滚滚向前,已然无法停止——小鼠推着历史前进,也被历史碾在轮下。




