
来源:环球科学ScientificAmerican
V型CRISPR系统中的核心蛋白Cas12b(也被称C2c1),在过去很难在人类细胞中完成基因编辑,因为Cas12b蛋白家族的最适反应温度通常都比较高。张锋今天发表在《自然·通讯》上的文章提到,一种通过改造的Cas12b蛋白可以在常温,高效、高准确性地完成基因编辑。张锋在文献中描述到:这种BhCas12b比Cas9的编辑精准性更高。这是基于Cas9的第三代可用于人类细胞的基因编辑工具。
但是在一个多月前,来自中科院动物所的科学家已经发表论文,内容也同样是基于改造Cas12b发明了新一代的基因编辑系统。这与张锋的新研究不谋而合,那么二者之间会不会掀起新一场CRISPR技术专利之争呢?
这种颇具潜力的Cas蛋白被称为BhCas12b,其是从外村尚芽孢杆(Bacillus hisashii)中提取出来,而并非常规的耐酸嗜热菌。BhCas12b能在37℃条件下保持酶活性,但会造成非靶向性DNA切除,编辑效率并不高。张锋通过针对BhCas12b的特定突变,将其进行了改造之后,其展现出了强大的基因编辑效率。在人类细胞系以及人体提取的原代T细胞中都在展现出了优秀的编辑能力。
既然是第三代工具,为什么叫V型CRISPR系统呢?我们首先需要了解的是第三代是指第三种可以用于人类细胞的基因编辑工具,而V型指的是Cas蛋白家族的亚型。这是两种不同的概念。
在CRISPR系统中,基本可以分为2类
第一大类:
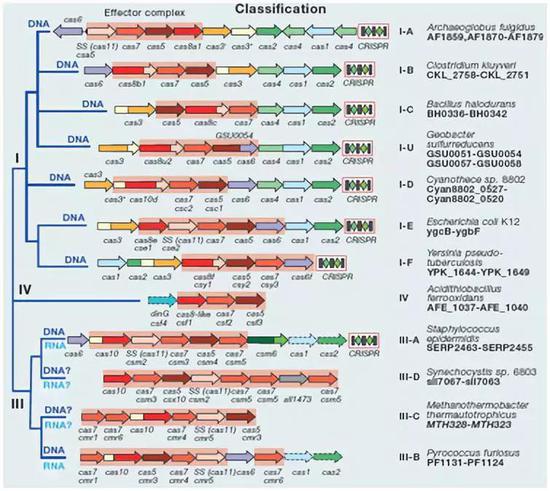
包括I型(Cas3)、III型(Cas10)、IV型(Csf1)
这一类系统是由多个蛋白亚基组成的效应子模块,在细菌和古细菌中已经鉴定的CRISPR/Cas系统中占到约90%,可以靶向RNA或者DNA。从下图中可以看到除了III型的CRISPR系统都需要依托于模块蛋白Cas1以及Cas2,同时还包括辅助蛋白质,如执行逆转录酶功能的Cas4和结构域蛋白的CARF。
第二大类:
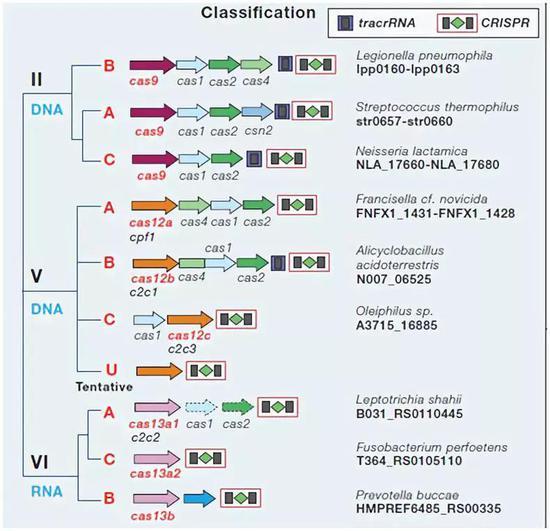
这类是我们比较熟知的CRISPR系统,经过改造已经在2013年实现了真核生物基因组的编辑。包括II型(Cas9)以及张锋在2015年通过序列对比和系统分析发现的V型(Cas12),V型中已经得到开发的V-A型又称Cas12a或Cpf1。而今天这篇文献所说第三代也就是Cas12b或C2c1。
这一类效应子模块只包含单个蛋白,但这个蛋白较大且包含多个结构域。其占到CRISPR系统中基因座的10%左右,已经在不同的细菌种属发现,但是古细菌中难觅踪迹。II型和V-B型包括tracRNA的组件(用于反式激活CRISPR RNA)。
今天发表的Cas12b与张锋团队此前发表的Cas9以及Cas12a比较如下:
Cas9系统:Cas9蛋白+双链引导RNA+CRISPR RNA(crRNA)+tracRNA;包含HNH和RuvC结构域
Cas12a系统:Cas12a蛋白+单链引导RNA+CRISPR RNA;包含RuvC结构域
Cas12b系统:Cas12b蛋白+双链引导RNA+CRISPR RNA+tracRNA;包含RuvC结构域
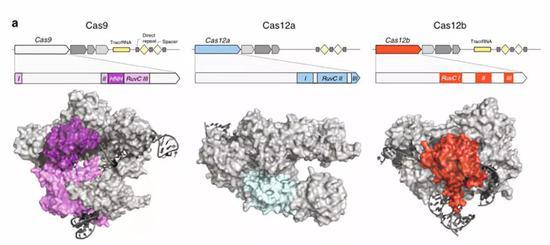
但Cas12b有一个绝对优于前面两者的特点,那就是蛋白小。在基因编辑实验中,通常都需要借助病毒载体将CRISPR系统转染到细胞中,蛋白表达基因越小就意味着越容易进入细胞。此前科学界已经在嗜酸耐热菌中发现了AacCas12b,但它的最适酶活温度在48℃左右,显然这并不适合在37℃的哺乳动物体内进行工作。
因此张锋选择了重新寻找更加合适的Cas12b。其通过数据库测序比对分析发现了27种包含V-B结构域的Cas12b,他们发现V-B型系统在各种类型的细菌中都有,暗示它的传递性会更广。在多种筛除手段后,实验结果显示AKCas12b和BhCas12b在37℃能表现出很强的酶切活性。但实际操作中,将两个蛋白导入细胞后发现两者的敲除效率都低于1%。张锋通过改变tracRNA和crRNA的联结架构后,发现BhCas12b的酶活能提升至原来的30倍,而AKCas12b几乎没有变化。至此基本可以确定BhCas12b是他们想要的最优蛋白。
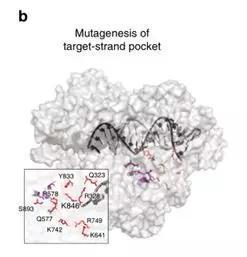
但是在这种活性下,精准度成了问题,实验结果显示在37℃时BhCas12b倾向于去切割非目的片段的DNA,也就是常说的脱靶效应。张锋认为这是BhCas12b的Ruvc端出了问题,让靶标DNA难以结合定位。因此他们决定对蛋白结构进行改造,他们一共分别对176种蛋白进行了突变,并且分析了其切割效应,其中K846R和S893R的改变会明显提升切割的活性和准确性。他们推断,这两个区域分布的精氨酸链对核酸骨架交互起重要作用,因此这种突变提升了BhCas12b与目标DNA的亲和度,促进了DNA切割。
此外,像BhCas12b这种酶活温度相对于嗜热菌里的Cas12b已经属于适冷酶了,这种酶的表面会布满许多甘氨酸,从而可以增加其酶活和延展性。张锋也同样检测了这些甘氨酸突变的效果,结果显示,在66中表面甘氨酸中,E837G的突变可以将酶活升至两倍。

最后他们将上述的三个突变合并到了一个Cas蛋白中,称其为BhCas12b v4,这种Cas蛋白可以在37℃下完成精准高效的实验。相较于第一代Cas9和第二代Cas12a,其脱靶率极大降低,在张锋进行编辑的细胞中,第三代编辑工具的脱靶率为0,而Cas9在9个实验中有6个出现了脱靶。
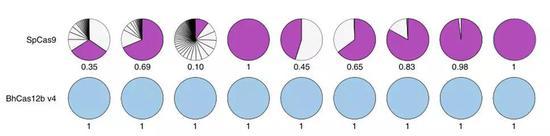
张锋发表的第三代基因编辑工具可以说是非常完美的,其拥有与Cas9媲美的DNA酶切活性,并且靶标准确性远超Cas9。只是,已经有人先其一步。中科院动物所在2018年12月就发表论文表示找到并构建了CRISPR/Cas12b编辑工具。(下图蓝条论文)


从标题来看,两者几乎就是做的一件事情——改造后的Cas12b可以成为新一代基因编辑工具。当然Cas12b蛋白的细菌来源以及改造工程并不一样。中科院动物所李伟和周琪研究员同样发现许多嗜酸耐热菌中的Cas12b酶活温度在37℃以上,但是他们找到了Alicyclobacillus acidiphilus 中的AaCas12b,其酶活反应温度异常广,在31℃-59℃之间都能保持高效酶切反应。他们所做的改造工程是将crRNA和tracRNA整合设计成单独茎环,与双链RNA工作,此举也能极大提高酶活效率。经过改造后其同样能实现张锋团队高效、高准确性的Cas12b结果。
说到CRISPR必定少不了专利之争,Jennifer Doudna与张锋曾就CRISPR/Cas9技术争夺了近数年,Jennifer先于张锋提交专利,其认为申请专利应遵循“先递交者获得专利”的最新规则。而张锋则认为申请呈递时的旧规则为“先发明者获得专利”,Jennifer只提供了思路而未发明出来,专利应属于自己。他在2013年申请了加急专利,2014年获得批准,此后二者就开展了专利大战。
直到2017年2月15日,美国专利及商标局终于做出裁决——三名法官一致认为张锋所在的Broad研究所申请的CRISPR/Cas9基因编辑专利,与加州大学伯克利分校Jennifer的CRISPR/Cas9发现,并不存在冲突(“no interference in fact”)。换句话说,两家申请的专利涵盖并不重复,因此张锋与Broad研究所继续保留在2014年获批的CRISPR/Cas9专利权。
那么这个第三代工具究竟会不会又引起纷争呢?就此相关问题《环球科学》采访了武汉科技局的相关人员。根据对话,我们了解到专利申请本身周期较长,通常一个专利申请呈递上去后正常情况下需要20个月才能审批下来,而动物所申请国际专利的时间跨度可能就更大。在专利发表之前网络搜索不到申请内容,因此张锋有没有申请专利,目前处于专利申请哪个阶段是不可知的。
此外,文献发表时间的早晚与专利申请之间没有必然联系,只要专利申请提交日期在文章发表前即是有效的。也就是说现在虽然中科院动物所的文献发表较早,但是只要张锋的专利先于其提交上去并被批准,仍然能抢先拿到专利。
况且,从Jennifer当年与张锋的专利之争看来,专利的界限定位可以非常小,也就是说只要创新度足够,是完全可以成为两个“并不存在冲突”的专利申请。从目前两篇文献来看,二者的发现过程,改造过程,应用方法是完全不一样的,因此成为互不冲突的专利机会很大。在2018年,李伟和周琪也基于张锋2015年释出的第二代CRISPR/Cas12a,创新后发表了相关专利。

第三代基因编辑工具究竟鹿死谁手还未可知,当然,如果能够皆大欢喜各捧一个回家是最好的结果。但是,科学竞赛也是残酷的,时间就是胜利这句话在科研领域是至圣名言,毕竟名垂千史的永远只有第一个发现者。



