癌症是一种基因疾病,它可能发生在身体的任何部位,每年都有大量的人因癌症去世。一直以来,对癌症基因组的研究都集中在蛋白质编码基因上,可这些基因加起来只占基因组的1%。最近,由多国学者和医生组成的国际合作团队进行了一项对另外99%的基因组的探索,完成了迄今为止最全面的癌症全基因组研究。
这项计划名为全基因组泛癌症分析(PCAWG),是一项以ICGC/TCGA(全球癌症基因组协会 / 癌症基因组图谱计划)的工作为基础开展的研究。

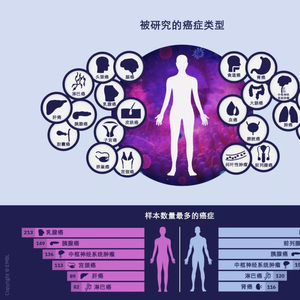
○ 上:PCAWG所研究的不同癌症类型。下:前6种可获得最多样本的癌症类型(男性和女性)。 | 图片来源:Rayne Zaayman-Gallant/EMBL
共有来自37个国家的1300多名科学家和临床医生参与到了这项研究中。他们分为16个科研组,对38种不同的癌症类型的2600多个基因组进行了详细深入的研究,创建了一个巨大的原发性癌症基因组数据库。这个数据库极大地提高了我们对癌症的基本认识,为癌症的诊断和治疗指明了新的方向。

○ 图片来源:PCAWG / ICGC Data Portal
2月5日,PCAWG研究团队将他们对2600多个全癌症基因组的综合分析发表在了《自然》期刊上。除此之外,他们将通过全基因组测序而获得的各项不同研究成果,以21篇论文的形式发表在了《自然》及其附属期刊上。
对全基因组进行测序能带来非常巨大的优势,比如其中一项就是可以对结构变异进行分析,不再局限于针对点突变的描述。结构变异可以为肿瘤中的基因组病变类型提供更丰富、更准确的信息。他们用一系列论文介绍了结构变异的原因和模式,阐述了结构变异对肿瘤发生的作用,强调了它们在临床医学上的潜在意义。
此外,对全基因组进行测序还能更清晰地了解全基因组的突变特征的模式,从而使我们对致癌的病因学有更深刻的认识。突变特征指的是特定的核苷酸发生了的特殊变化,它反映了内源性或外源性诱变力与分子修复过程的共同作用。
还有两篇论文描述了PCAWG的研究人员如何利用从全基因组测序中获得的信息,对影响肿瘤演化的参数以及这些参数会如何形成癌症基因组,进行更精确地描绘。由于癌细胞会受突变率和微环境等因素的影响,因此从演化的角度看待癌症,可以为癌细胞的转移、治疗反应以及耐药性提供重要线索。
一直以来,了解变异会如何驱动癌症的发展是癌症基因组学的一个重要目标。几乎所有的驱动突变都是在基因中发现的。对肿瘤进行全基因组测序可以更好地在非编码区域捕捉到反复出现的驱动突变,为了解癌症的发展和治疗开辟了一条新的途径。
对正常基因表达程序造成干扰有可能会导致癌症,但由于基因调控非常复杂,因此分析基因调控是是一项极具挑战的工作。来自全基因组测序和转录组数据的信息就可以使我们更全面地了解癌症中基因组变异和转录异常之间的关系。
尤为值得一提的是,在一同被发表的论文中,有6篇论文介绍了在此次研究中扮演着重要角色的算法与技术。PCAWG研究除了获得了巨大的生物学和医学方面的学术成果之外,还伴随有重大的技术性飞跃。研究人员所使用的是可用于高通量数据分析以挖掘全基因组癌症数据集的新的方法和技术。通过使用云计算或深度学习等方法,为学界提供了一套可用来进一步研究癌症组学数据的工具。

○ 云计算:数据保存在世界各地的数据中心,计算算法则在云中。 | 图片来源:Rayne Zaayman-Gallant/EMBL
PCAWG所报告的研究结果可以总结如下:
癌症基因组是有限的、可知的,但也极其复杂。通过将全癌症基因组的测序与先进的分析工具相结合,研究人员可以对在癌症中发现的每一个基因变化、所有产生这些突变的过程,甚至癌症的生命过程中的关键事件的发生顺序进行描述。
研究人员即将完成对所有与癌症有关的生物路径的编目工作,并且他们也对这些路径在基因组中所起的作用有了更全面的了解。几乎在所有被分析的癌症中,他们都发现了至少一种因果突变,并且发现突变的产生过程非常多样,它可以是DNA上的单个碱基发生变化,也可以是整个染色体都进行了重组。基因组中超过12个控制基因开关的区域被确定为致癌突变的目标。
他们发现了一种能识别出在肿瘤出现之前的几年甚至几十年里所发生的突变的新方法。从理论上看,这为早期癌症检测开辟了一条新的道路。
根据在全基因组中观测到的遗传变化模式,肿瘤类别可以被准确地识别,这有望帮助诊断出用传统的临床试验无法识别的癌症类型。掌握确切的肿瘤类型有助于医生调整治疗方案。

○ 研究表明,我们的细胞中宛若有一个分子钟。 | 图片来源:Rayne Zaayman-Gallant/EMBL
总的说来,PCAWG是世界各地学者在经过10年的合作之后,对全癌症基因组得到的空前成果。随着对肿瘤的起源和演化的了解越来越深入,我们将有望研发出新的工具和疗法来更早地发现癌症,从而提高癌症治疗的成功率。
通过分析各种肿瘤类型中癌细胞的分子畸变,PCAWG已经成为了识别会导致癌症的常见路径的一个有力工具。这些结果为癌症的分子驱动因素提供了新的见解,并为科学界推进癌症研究提供了极为宝贵的资源。
参考链接:
[1] https://www.nature.com/immersive/d42859-020-00001-y/index.html
[2] https://news.ucsc.edu/2020/02/pcawg-papers.html
[3] https://www.embl.de/campaigns/pancancer/index.html